PROPIEDADES
|
ORGANO LEPTICOS
|
INTENSIVOS
|
EXTENSIVOS
|
|||
SUSTANCIAS
|
COLOR
|
SABOR
|
VISCOSIDAD
|
DENSIDAD
|
VOLUMEN
|
PESO
|
Inca Kola
|
amarilla
|
dulce
|
claro
|
1.424kg
|
1.424 ml3
|
1400 g
|
Pony malta
|
negra
|
dulce
|
oscura
|
1.212 kg
|
1.212 ml3
|
1200 g
|
Aceite
|
||||||
ACEITE DE OLIVA
|
amarilla
|
amarga
|
claro
|
1.500kg
|
1.500ml3
|
1500g
|
viernes, 29 de mayo de 2015
Deber
domingo, 24 de mayo de 2015
UNIDAD 2
NUMERO
DE OXIDACIÓN:
El número de
oxidación es un número entero que representa el número de electrones que un
átomo recibe (signo menos) o que pone a disposición de otros (signo más) cuando
forma un compuesto determinado.
Eso significa que el
número de oxidación es positivo si el átomo pierde electrones, o los comparte
con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo
gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
CLASIFICACIÓN DE METALES Y NO METALES POR SU VALENCIA

CLASIFICACIÓN DE METALES DE VALENCIA VARIABLE

FORMULACIÓN DE COMPUESTOS

FORMULACIÓN DE COMPUESTOS
¿QUE ES UN COMPUESTO?
Un compuesto es
una sustancia formada por la
unión de dos o más elementos de la tabla
periódica. Una característica esencial es que tiene una fórmula
química. Por ejemplo, el agua es
un compuesto formado por hidrógeno y oxigeno en
la razón de 2 a 1 (en número de átomos): .
Los
compuestos químicos se pueden clasificar en:
* El
hidrógeno (H) presenta número de oxidación +1 con los no metales y –1 con los
metales.
* El
oxígeno (O) presenta el número de oxidación –2, excepto en los peróxidos donde
es –1.
* El
compuesto se lee de derecha a izquierda
* Se
intercambian las valencias, pero prescindiendo del signo
Siempre que sea
posible se simplifica
Sistemas de
Nomenclatura
Hay 3 tipos de
nombres para los compuestos:
· Clásica
o tradicional
· Stock
· Sistemática
o IUPAC
Nomenclatura clásica o tradicional
Se refiere al nombre que resulta de la combinación de 2 palabras que
establecen la identificación de un compuesto, basándose en la función química
que lo constituye.
Se usan generalmente los siguientes prefijos y sufijos.
En donde los sufijos se usaran cuando el compuesto
trabaje con 2 valencias: oso para la menor e ico para la mayor.
Los prefijos se usaran cuando el compuesto trabaje
con 4 valencias:
Hipo……..oso
Oso
Ico
Per……..ico
EJEMPLO
H2SO4 : ácido hiposulfuroso
Au2O : óxido auroso
Ni2O3 : óxido niquélico
Nomenclatura Stock
Consiste en colocar entre paréntesis e inmediatamente después del nombre
del elemento un número romano que indica el estado de oxidación del mismo.
Ejemplo:
NOMENCLATURA SISTEMATICA
Se basa en nombrar a las sustancias usando
prefijos numéricos griegos que indican la atomicidad de cada uno de los
elementos presentes en cada molécula. La atomicidad indica el número de átomos
de un mismo elemento en una molécula.
FORMULACIÓN DE
COMPUESTOS:
ÓXIDOS BÁSICOS
Estos compuestos se forman a partir de un metal +
Oxigeno
ÓXIDOS ÁCIDOS O ANHÍDRIDOS
Estos compuestos se forman a partir de un No metal
+ Oxigeno
PERÓXIDOS
Estos compuestos se forman a partir de un Oxido
Básico + O
ÓXIDOS SALINOS
Este tipo de compuesto trabaja con los metales de
valencia variable
HIDRUROS
Este compuesto se forma a partir de un Metal +
Hidrogeno
HIDRACIDOS
Este compuesto de forma del Hidrogeno+ No metal de
la familia 1 y 2
Los Hidrácidos que se forman con la familia 3 y 4
reciben el nombre de “compuesto especial”
COMPUESTOS TERNARIOS
HIDRÓXIDOS
Este compuesto se puede formar de 2 maneras:
1. Oxido+H2O
2. Metal + (OH)
OXACIDOS
Estos se forman a partir de un Oxido acido o
Anhídrido + H2O
Hay casos especiales en donde se suman 2 y 3
Moléculas de agua (H20) en la familia 3 y 4
SALES TERNARIAS
Se forman a partir de oxácido + hidróxido =
sal neutra + agua
Quedando de la siguiente manera:
Metal (Anhídrido) + H20


Bloque
de la tabla periódica

CLASIFICACIÓN DE
LOS ELEMENTOS DE LA TABLA PERIÓDICA
La primera clasificación de elementos conocida, fue propuesta por Antoine
Lavoisier, quien propuso que los elementos se clasificaran
en metales, no metales y metaloides o metales de
transición. Aunque muy práctico y todavía funcional en la tabla periódica
moderna, fue rechazada debido a que había muchas diferencias tanto en
las propiedades físicas como en las químicas.
· Antoine-Laurent
de Lavoisier químico, biólogo y economista francés, considerado
el creador de la química moderna, junto a su esposa, la
científica Marie-Anne Pierrette Paulze, por sus estudios sobre la
oxidación de los cuerpos, el fenómeno de la respiración animal,
el análisis del aire,
la ley de conservación de la masa o ley Lomonósov-Lavoisier,
la teoría calórica y la combustión.
· Se llama metales a
los elementos químicos caracterizados por ser buenos conductores
del calor y
la electricidad.
Poseen alta densidad y
son sólidos en temperaturas normales (excepto el mercurio); sus sales
forman iones electropositivos (cationes) en disolución.
Los metales los solemos clasificar de la siguiente forma:
· Metales
reactivos. Se denomina así a los elementos de las dos primeras columnas
(alcalinos y alcalinotérreos) al ser los metales más reactivos por regla
general.
· Metales de
transición. Son los elementos que se encuentran entre las columnas largas,
tenemos los de transición interna (grupos cortos) y transición externa o
tierras raras (lantánidos y actínidos).
· Otros metales.
Son los que se encuentran en el resto de grupos largos. Algunos de ellos tienen
propiedades de no metal en determinadas circunstancias (semimetales o
metaloides).
· Propiedades
de los metales.
Por regla general los metales tienen las siguientes propiedades:
· Son buenos
conductores de la electricidad.
· Son buenos
conductores del calor.
· Son
resistentes y duros.
· Son brillantes
cuando se frotan o al corte.
· Son maleables, se
convierten con facilidad en láminas muy finas.
· Son dúctiles, se
transforman con facilidad en hilos finos.
· Se producen
sonidos característicos (sonido metálico)
cuando son golpeados.
· Tienen altos
puntos de fusión y
de ebullición.
· Poseen elevadas
densidades; es decir, tienen mucha masa para su tamaño: tienen muchos átomos
juntos en un pequeño volumen.
Propiedades de los no metales:
· Son malos
conductores de la electricidad.
· Son malos
conductores del calor.
· Son poco
resistentes y se desgastan con facilidad.
· No reflejan
la luz como
los metales, no tienen el denominado brillo metálico. Su superficie no es tan
lisa como en los metales.
· Son frágiles, se
rompen con facilidad.
· Tienen
baja densidad.
· No son atraídos
por los imanes.
· Tienen tendencia
a formar iones negativos.
Hay algunas excepciones a las
propiedades generales enunciadas anteriormente:
· El diamante es un
no metal pero presenta una gran dureza.
· El grafito es un
no metal pero conduce la electricidad.
·
No Metales, Metales y Metaloides de la tabla periódica:


Enlaces
Químicos
Son la unión de átomos que forma
moléculas existen 3 tipos de enlaces:

1. Enlaces Iónicos
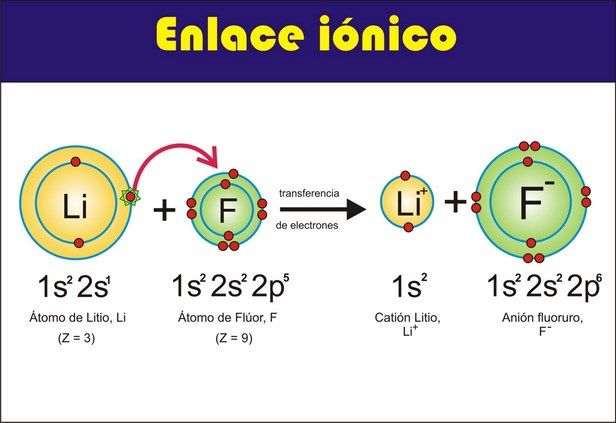
2. Enlace Metálicos
3.
Enlace Covalentes
Modelos Atómicos
Modelo Atómico de Dalton
Lanzo su modelo atómico en 1808 considerado como el padre de la teoría atómica, los principales fundamentos de esta teoría fue:
*La materia esta formada por minúsculas partículas indivisibles llamada átomos
*Los átomos de un mismo elemento poseen la misma propiedad química y los átomos de diferentes elementos tienen distintas propiedades químicas
*Los compuestos se forman combinado átomos de dos elementos
*En las reacciones químicas los átomo se intercambian de una a otra sustancia pero ningún átomo desaparece ni se destruye


*La materia esta formada por minúsculas partículas indivisibles llamada átomos
*Los átomos de un mismo elemento poseen la misma propiedad química y los átomos de diferentes elementos tienen distintas propiedades químicas
*Los compuestos se forman combinado átomos de dos elementos
*En las reacciones químicas los átomo se intercambian de una a otra sustancia pero ningún átomo desaparece ni se destruye

Modelo atómico de Thomson
El modelo atómico de Thomson es una teoría sobre la
estructura atómica propuesta
en 1904 por Joseph John Thomson, quien descubrió el electrón en
1897, mucho antes del descubrimiento del protón y
del neutrón.
Descubridor del electrón en el cual dicho modelo está compuesto por
electrones de carga negativa y la masa total o general del átomo positiva

Modelo Atómico de Rutherford
Lanzo su modelo atómico en 1911 tomo como ejemplo nuestro sistema solar al plantear que el átomo tiene un núcleo de carga positiva y electrones de carga negativa los electrones giran alrededor del núcleo provocando que el átomo sea electrónica mente neutro.
Modelo Atómico de Bohr
Lanzo su modelo atómico en 1913 tomo el modelo atómico de Bohr pero el núcleo estaba formado por los protónes de carga positiva y mientras los electrones giran alrededor de la misma, un electrón puede salta de un orbital de mayor energía a uno de menor energía.
Modelo Cuántico
El científico Schrödinger lanzo su modelo macano-cuántico en este modelo se dio a conocer que los electrones no son estáticos y que están en el átomo girando alrededor de núcleo es decir que no se puede identificar su posición exacta.
En este modelo se descubrió el neutrón quien es de carga nula y su peso es ligeramente mas alto que el de el protón.

Electrón: Carga negativa gira alrededor del núcleo en sus orbitales
Neutrón: Carga nula forma parte del núcleo del átomo junto con el protón
Protón: Carga positiva forma parte del núcleo del átomo junto con el neutrón
Números Cuánticos
¿Qué son los números cuánticos?
Los números cuánticos son los que nos sirven para encontrar un electrón en su orbital.
Los números cuánticos son 4:
1 El numero cuántico principal
2 El numero cuántico secundario
3 El numero cuántico magnético
4 El numero cuántico espín
Principal ( n ) Determina el nivel de energía en el que esta el electrón

Azimutal Determina el subnivel de energía en el que se encuentra el electrón

Magnético Indica la orientación espacial del subnivel

Espín Determina el giro o sentido en que gira el electrón en su propio eje para determinar su valor:
un medio o - un medio.


Configuración Electrónica
Es la distribución de electrones en cada nivel de energía, los niveles de energía se representa con letras s, p, d, f.
para realizar la configuración electrónica se considera la distribución de los electrones con su respectivo nivel de energía,subnivel,orbital.
Suscribirse a:
Comentarios (Atom)




